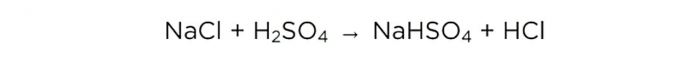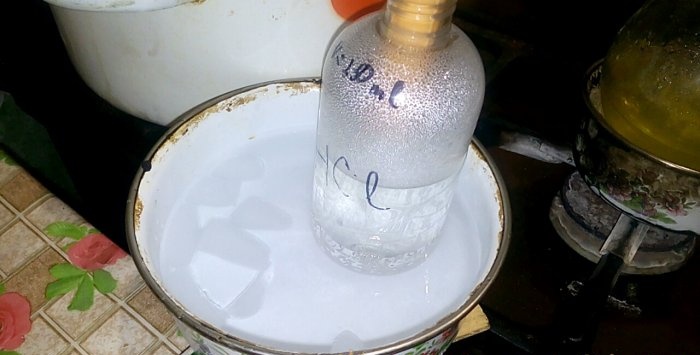Alchemisten die in de 15e eeuw voor het eerst zoutzuur produceerden, noemden het ‘spiritus salis’, ‘geest uit zout’. In die tijd had dit zuur magische eigenschappen: het corrodeerde papier, loste metalen op en vergiftigde mensen. Deze eigenschappen blijven tot op de dag van vandaag bestaan, maar nu is dit zuur voldoende bestudeerd en is er hier geen sprake van magie.
Zoutzuur (HCl) is een sterk monobasisch zuur, in zuivere vorm is het een transparante vloeistof. Bij de maximale concentratie van 38% “rookt” het in de lucht. We krijgen zuur met een concentratie van de helft daarvan.
Dus laten we beginnen.
Veiligheidsmaatregelen
Wees voorzichtig bij het werken met giftige stoffen!
Alle experimenten moeten worden uitgevoerd in een goed geventileerde ruimte of onder een kap. Zorg ervoor dat u een veiligheidsbril (verkrijgbaar bij een bouwmarkt) en handschoenen draagt (als u geen speciale chemische handschoenen kunt vinden, zijn handschoenen van goede kwaliteit geschikt voor de afwas).
Op de plaats van het experiment moet zuiveringszout aanwezig zijn om in een onvoorziene situatie het zuur te neutraliseren (hierbij komen kooldioxide en water vrij).
Het is ten strengste verboden om experimenten uit te voeren in metalen containers.
Zal nodig hebben
Om het experiment uit te voeren hebben we nodig:
- Zure elektrolyt voor batterijen (verkocht in een autowinkel);
- Gedestilleerd water (ibid);
- Tafelzout (verkrijgbaar in elke keuken);
- Zuiveringszout (zie veiligheidsmaatregelen).
Van de gerechten die je nodig hebt:
- Glazen fles;
- Een bakje met zand waar je de fles in kunt plaatsen;
- Diverse wegwerpbekers 200 ml;
Als u een hittebestendige fles heeft, kunt u deze onder de open vlam van een brander verwarmen. Maar ik raad toch aan om zand te gebruiken, in dat geval absorbeert het zuur.
Je hebt ook een paar loodgietershoeken nodig met een diameter van 50 mm en een brander (in mijn geval alcohol, maar ik raad aan een gasbrander te gebruiken).
Fase 1 - verdamping
Het elektrolyt voor batterijen bestaat uit 36% zwavelzuur (H2SO4). Eerst moeten we de concentratie ervan verhogen.
Giet 200 ml in het glas, dat wil zeggen bijna tot de rand, en giet iets meer dan de helft van het glas in de kolf. Maak een markering met een stift en voeg de rest toe.
Ik plaatste een foliereflector rond de fles voor een efficiëntere verwarming, maar verwijderde deze later omdat deze begon te smelten.
Zet nu de kolf op de brander en verdamp tot het niveau van de eerder ingestelde markering, zelfs iets lager.
Tegelijkertijd leggen we gaas meerdere keren gevouwen op de hoek en zetten het vast met een elastische band. Bereid een onverzadigde frisdrankoplossing voor en dompel het uiteinde van de hoek er met gaas in.
Wanneer de elektrolyt begint te koken, plaatsen we een hoek op de kolf, deze zit er stevig op. We richten het gaasuiteinde in het open raam.
Dit is nodig als plotseling het zwavelzuur zelf samen met het water begint te verdampen. Als je de fles niet te veel oververhit, zal dit niet gebeuren.
Brander in actie:
Mijn brander heeft een relatief laag wattage, dus het verdampen duurde ongeveer een uur.Een gasbrander of elektrisch fornuis zou dit proces aanzienlijk versnellen.
Na voltooiing van de eerste fase moet iets minder dan de helft van de oplossing in de kolf achterblijven, dat wil zeggen een zuur met een concentratie van ongeveer 75%. Vergeet de nauwkeurigheid niet.
Laat het afkoelen tot kamertemperatuur.
Fase 2 - berekeningen
Nu we zwavelzuur hebben geconcentreerd kunnen we de basisreactie uitvoeren, deze ziet er als volgt uit:
Maar laten we eerst wat berekeningen doen, en aan het einde zullen we ze vergelijken met wat er in de praktijk is gebeurd.
In eerste instantie hadden we dus 200 ml elektrolyt met een dichtheid van 1,27 g/cm³. Als we naar de tabel met dichtheden van zwavelzuur kijken, zien we dat deze dichtheid overeenkomt met een concentratie van 36%. Laten we het zuurvolume berekenen:
200ml*36%=72ml - V(H2SO4)
Nadat we de oplossing hadden verdampt, nam de concentratie ervan, en dus de dichtheid, toe. We kijken naar dezelfde tabel en zien dat een concentratie van 75% overeenkomt met een dichtheid van 1,67 g/cm³.
Als we de stroomdichtheid (p) en het volume (V) van het zuur kennen, ontdekken we de massa:
m=p*V;
m(H2SO4)=1,67g/cm³ * 72ml=120g;
m(H2SO4)=1,67g/cm³ * 72ml=120g;
Nu herinneren we ons van schoolchemie:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
waarbij M de molaire massa van de stof is.
waarbij M de molaire massa van de stof is.
De molmassa's van H2SO4, NaCl en HCl zijn respectievelijk 98, 58,5 en 36,5 g/mol. Nu kunnen we erachter komen hoeveel tafelzout er nodig is en hoeveel HCl we krijgen.
We hebben namelijk 72 g NaCl nodig, dat is 34 ml, laten we het teveel nemen - een kwart glas.
Geweldig, en HCl komt in theorie uit op 44,7 g.
De HCl-dichtheidstabel heeft een g/l-kolom. Van daaruit nemen we de waarde voor een concentratie van 15% - 166,4 g/l. Het watervolume dat nodig is om 15% HCl te verkrijgen is 44,7/166,4≈270 ml. We nemen 200 ml. Als resultaat krijg ik in theorie 22% zoutzuur.
Fase 3 - zuur verkrijgen
We verbinden de twee hoeken als volgt:
En de hele structuur zal er als volgt uitzien:
Het overeenkomstige zuur condenseert in een vat met het label HCl; het watervolume daarin is 200 ml. Markeer ook het huidige vloeistofniveau op deze container.
We verwijderen de hoeken en gieten de berekende hoeveelheid zout via een trechter in de kolf.
De oplossing wordt geel.
Om zoutzuur te laten vrijkomen, moet je de brander aanzetten. Maar eerst bevestigen we de hoeken stevig aan de kolf en het ontvangende vat.
Wanneer zuur in water condenseert, ontstaan er ‘verticale golven’. Bovendien warmt de oplossing op en moet deze worden gekoeld. U kunt bijvoorbeeld een ander vat met ijs eronder plaatsen.
De reactie verloopt relatief snel - 20 minuten, waarna je het vuur kunt uitzetten. Laat de laatste dampen zoutzuur oplossen in het water en sluit het vat vervolgens hermetisch af. Wanneer de kolf is afgekoeld, verdun je de resterende oplossing met water (ongeveer één op één) en giet je deze in het riool.
Kortom
Aan de hand van de markering op het vat bepalen we hoeveel vloeistof er is toegevoegd. Voor mij is het ⅙, dat wil zeggen 17%. Dit is de concentratie van ons zoutzuur. Laten we het vergelijken met wat in theorie is verkregen.
17%/22%*100%=77% - reactieopbrengst.
Het is belangrijk op te merken dat er geen output gelijk is aan 1, er zijn altijd verliezen. In mijn geval is dit een onvoldoende verdampte elektrolyt. Idealiter zou de concentratie zwavelzuur 90-95% moeten zijn.
Laten we het resulterende zuur controleren op interactie met metaal.
We observeren een snelle evolutie van waterstof. Dit betekent dat het zuur geschikt is voor verdere experimenten.
Variaties
Als fles kun je een schone glazen fles bier of frisdrank gebruiken, maar op voorwaarde dat de verwarming zo soepel mogelijk verloopt. In plaats van PVC-hoeken kunt u polypropyleen buizen en hoeken met een kleinere diameter nemen (geschikt voor uw fles).
Ik verzoek u nogmaals om de veiligheidsmaatregelen te volgen. Fijne ervaringen allemaal!